
BioStellar® Plateを用いた腸肝共培養システム:
薬剤吸収・代謝を同時評価できる新たな評価系
はじめに
医薬品開発における薬効・安全性評価において、動物実験はこれまで不可欠な手法として広く用いられてきました。しかし、動物愛護の観点からの倫理的課題や、種差に起因するヒトへの外挿性の限界が指摘されています。これらの課題を克服するため、動物実験代替法としてin vitroモデルの重要性が高まっています。なかでも、ヒト生体環境を模倣する「Microphysiological Systems(MPS)」は次世代の医薬品評価プラットフォームとして大きな期待が寄せられています。
住友ベークライト株式会社は、東海大学の木村啓志教授が考案したオンチップポンプ型多臓器MPS「BioStellar® Plate」を製品化しました。1) このMPSは複数の細胞や組織を連結し、臓器間相互作用を再現することで、生体内の複雑な機能を模倣することを目指しています。
本アプリケーションノートでは、BioStellar® Plateを用いた腸-肝共培養システムをご紹介します。このシステムは、小腸と肝臓を共培養することで、従来の単培養系では再現が難しかった薬剤の吸収や代謝における生体内挙動をより正確に再現する評価系を提供します。今後最適化を進めて生体再現度を一層高め、創薬支援の強力なツールとして幅広く活用されることが期待されます。
実験の概要
BioStellar® Plateは、2つのウェルが流路で連結された構造を持ち、流路内のスターラーバーを回転させることで簡便に灌流培養を行えるMPSです。市販のセルカルチャーインサートやカバースリップと組み合わせることで、最大4種類の細胞を共培養することが可能です。(図1, 図2)。
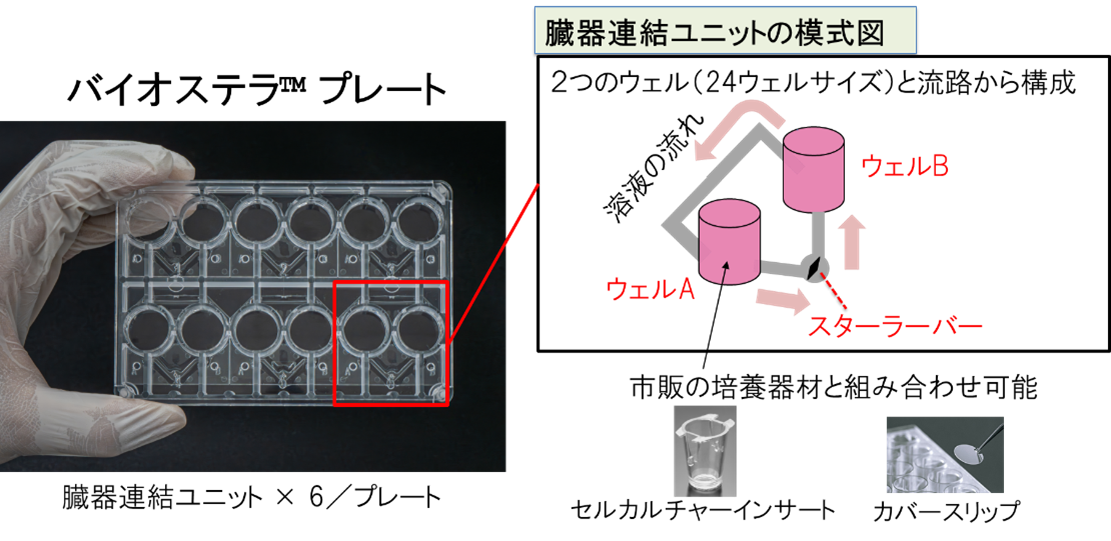
図1. BioStellar® Plateの概略図
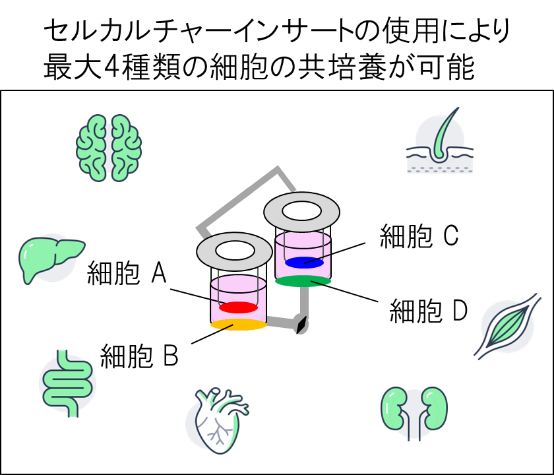
図2. 共培養系の概念図
小腸と肝臓は、経口投与薬の吸収および代謝に重要な役割を担う臓器であり、これらの挙動を評価することは薬剤の体内利用率を予測する上で不可欠です。先行研究では、BioStellar® Plate上で小腸と肝臓の細胞を共培養することで、肝細胞の代謝活性が向上するなど細胞機能の向上が確認されました。2) 本アプリケーションノートでは腸-肝共培養中の薬剤吸収および代謝を総合的に評価し、従来の単培養系よりも体内挙動を正確に反映するシステムを構築しました(図3)。
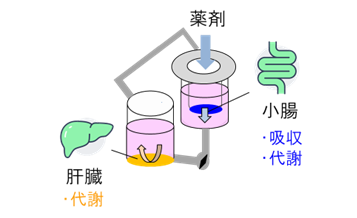
図3. 腸-肝共培養系の概念図
実験手順
(1) 前培養
小腸細胞は、ヒトiPS細胞由来腸管上皮細胞(F-hiSIEC™、富士フイルム)を使用し、セルカルチャーインサート(Transwell®、Corning)上で11日間培養を行いました。肝細胞は、ヒト化肝臓キメラマウス由来肝細胞(HepaSH®、ケー・エー・シー)を使用し、カバースリップ(スミロンセルデスクLF1、住友ベークライト)上で5日間培養しました(図4)。
(2) 腸-肝共培養
前培養したF-hiSIEC™(セルカルチャーインサート)、HepaSH®(カバースリップ)をBioStellar® Plateに移動し、腸-肝共培養を2日間実施しました(図3, 4)。スターラー装置の回転数は2500rpmに設定して灌流培養を行いました。比較対象として、小腸細胞および肝細胞の単独培養もそれぞれ実施しました。
(3) 薬剤評価
モデル化合物として、(S)-(+)-Clopidogrel Sulfate(以下、Clopidogrelと記載)を使用しました。この化合物は小腸で吸収され、肝臓のCES1酵素により代謝されて不活性型の化合物に変化することが知られています。本実験では、腸-肝共培養および腸単培養ではセルカルチャーインサート内部(以下、インサート内と記載)に、肝単培養ではウェルAおよびB(以下、ウェル内)に薬剤を添加しました。共培養開始後0, 1, 2, 4, 6, 24, 48時間後に培地をサンプリングし、LC-MS/MSを用いてClopidogrelおよびその代謝物Clopidogrel carboxylic acidの濃度を測定しました(図4)。
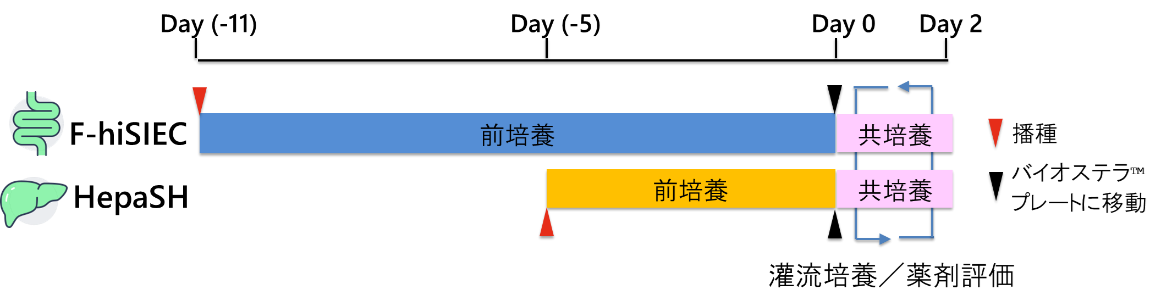
図4. 実験スケジュール
結果と考察
腸-肝共培養(図5A)および腸単培養(図5B)の両方で、インサート内の薬剤濃度の減少、ウェル内薬剤濃度の増加が観察されました。共培養系においても単培養系と同様に、小腸細胞を介した経時的な透過挙動を評価できることが示されました。
肝臓での代謝については、ウェル内での代謝物の増加が、腸-肝共培養(図5A)および肝単培養(図5C)の両方で確認されました。さらに投入薬剤量に対する代謝物量の割合が肝単培養と同程度であったこと(図6)から、共培養系でも肝細胞の機能が維持できていることが示されました。
腸-肝共培養(図5A)では肝単培養(図5C)に比べ、代謝物の増加が遅れる傾向がありました。この結果より、腸-肝共培養系では薬剤がインサート内からウェル側に透過した後に肝臓で代謝が行われるという、小腸での吸収から肝臓での代謝への一連の流れを経時的に評価できることが示唆されました。
また、ウェルAとBにおける薬剤濃度がほぼ同程度であったこと(図5A, 5B)から、BioStellar® Plate上で溶液が均一に攪拌されていることが確認されました。
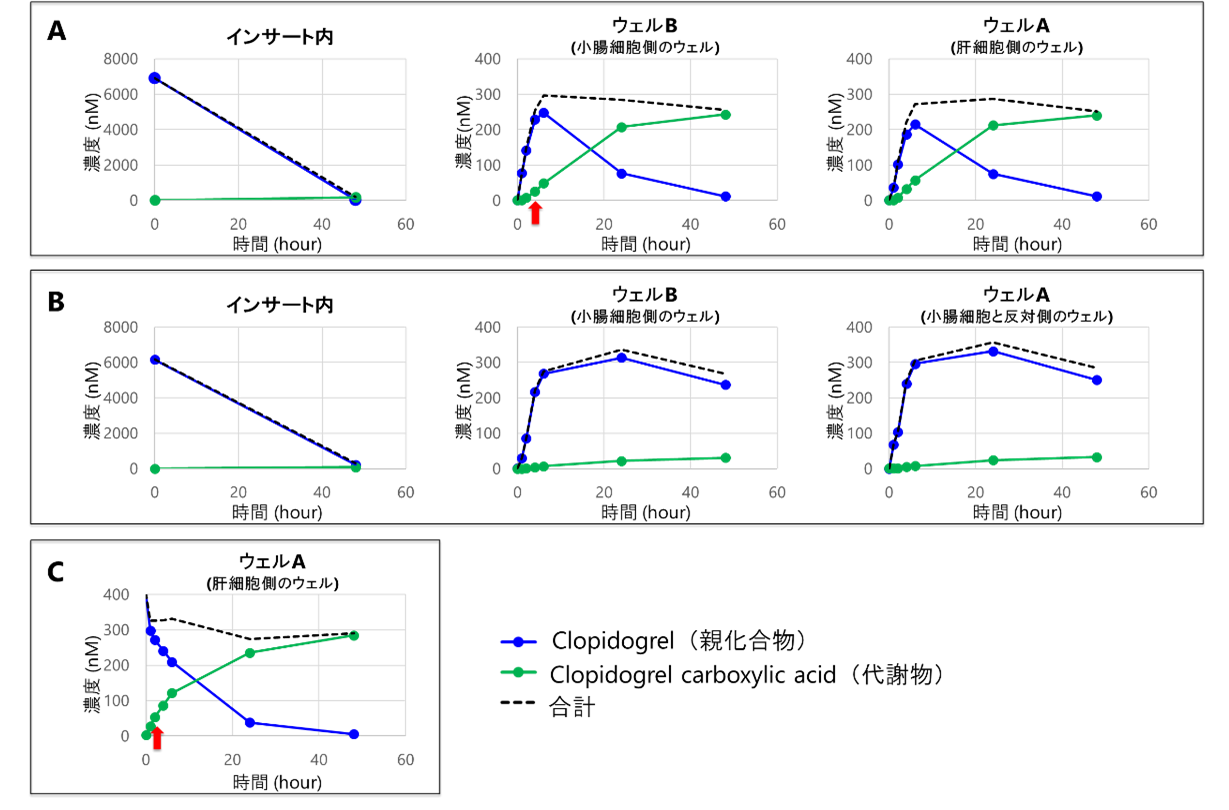
図5. インサート内/ウェルにおけるClopidogrelおよび代謝物の濃度
(A)腸-肝共培養、(B)腸単培養、(C)肝単培養
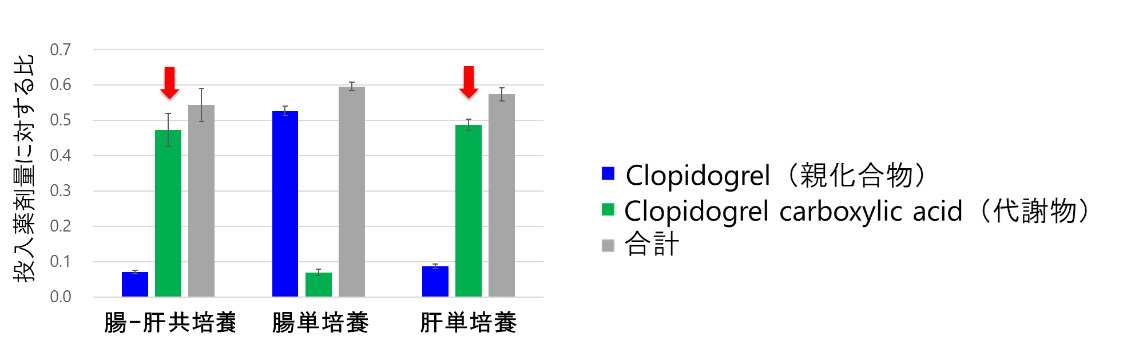
図6. Clopidogrelおよび代謝物の総量
まとめ
本研究では、BioStellar® Plateを用いて、薬剤の吸収および代謝を評価するための腸-肝共培養システムを構築しました。今回使用したモデル化合物において、薬剤の吸収と代謝の両方を反映した結果が得られ、本システムが従来の単独培養系よりも薬剤の体内挙動をより正確に評価できることが示唆されました。
BioStellar® Plateを用いた腸-肝共培養システムは、薬剤の吸収と代謝における生体再現性を高め、創薬支援における重要な手法として期待されます。今後、さまざまな吸収および代謝特性を持つ薬剤を評価し、ヒト臨床データとの比較を通じて、培養系の最適化を進めていきます。
謝辞
本アプリケーションノートで紹介した研究内容は、国立研究開発法人日本医療研究開発機構(AMED)の支援を受けて実施されたものです(課題番号JP17be0304201, JP22be1004201)。本研究は、東京大学 酒井研究室、金沢大学 加藤研究室、東海大学 木村研究室との共同研究として進められた成果です。関係者の皆様に心より感謝申し上げます。
参考文献
1) Shinha, K., Nihei, W., Nakamura, H. et al. (2021). Micromachines 12, 1-15
2) Kurniawan, D. A., Leo, S., Inamatsu, M. et al. (2024). PNAS Nexus 3, 1-10
製品情報
BioStellar® Plate
プレート内蔵のスターラーバーを専用装置で回転させて、簡便に灌流培養を行えるオンチップポンプ型多臓器MPSです。市販のセルカルチャーインサートと組み合わせて、最大4種類の細胞を同時に共培養可能です。24ウェルプレートと同じウェルサイズの解放系構造を採用しており、通常の培養器材と同等の操作性を実現しています。PDMSを使用していないため薬剤の吸着が少なく、評価時のロスを抑えられます。
セルデスクLF(低蛍光タイプ)
低バックグラウンドを実現したプラスチック製カバースリップです。接着細胞用の表面処理が施されており、細胞の固定・標本化に使用できます。低自己蛍光のため蛍光標識物を用いた免疫化学染色や細胞内局在性の観察に最適です。
| 品番 | 品名 | 内容物 | 参考価格(円・税抜) |
|---|---|---|---|
| BS-X9607 | BioStellar® Plate | 2枚/箱 | 100,000 |
| MS-92132 | スミロンセルデスク LF1 | 24/プレート・240/ケース | 33,600 |
※BioStellar® Plate専用のスターラ装置については、弊社までお問い合わせください。

